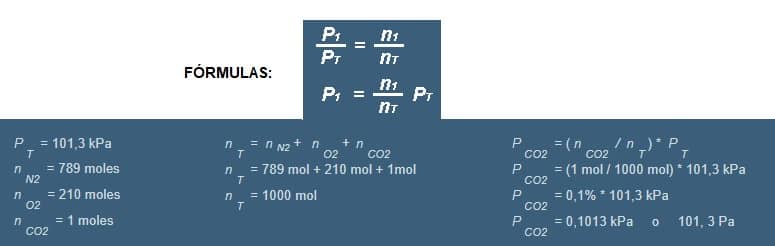Por regla general, los gases que nos rodean, como el aire, son mezclas de gases.
Cada tipo de gas en la mezcla de gases ejerce una presión parcial, cuyo valor corresponde a las proporciones del gas en la mezcla de gases.
La Ley de Dalton es una ley que habla sobre la presión total de una mezcla de gases ideales.
Recuerda: Gases ideales son los que no reaccionan entre si.
La presión ejercida por una mezcla de gases es la presión total, presión sentida y medible.
Una presión parcial es la parte de la presión total causada por uno solo de los gases de la mezcla.
Indice de Contenidos
La Ley de Dalton
La Ley Dalton, también llamada de las presiones parciales dice que, a una temperatura dada, la presión total de una mezcla de gases es igual a la suma de las presiones parciales ejercidas por cada uno de los gases que componen la mezcla.
La presión individual ejercida por cada uno de los gases en un recipiente se llama presión parcial.
Esta presión representa solo una parte de la presión total ejercida por todos los gases contenidos en el recipiente.
Aunque esta ley solo sería aplicable en gases ideales, no reales, se puede aplicar en gases reales con un error muy pequeño.
Ejemplo con el aire a nivel del mar:
Presión ambiente 1 bar.
Porcentaje de oxígeno en el aire 21% ==> 0,21 bar
Proporción de nitrógeno en el aire 0,79% ==> 0,79 bar
Presión total 0,21 bar + 0,79 bar = 1 bares
Fórmula Ley de Dalton
Matemáticamente, podemos expresar la ley de las presiones parciales, también llamada ley de Dalton, de la siguiente manera:
Ptotal = P1 + P2 + P3….
Ptotal = Presión Total de la Mezcla
P1 = Presión del gas 1
P1 = Presión del gas 2
P1 = Presión del gas 3
OJO todas las presiones se deben de medir en las mismas unidades, por ejemplo en atmósferas, en Kpa, en mm Hg, en bares, etc.
además todas las presiones deben de haberse medido en el mismo recipiente y a la misma temperatura, es decir en el mismo volumen (recipiente) y temperatura.
Matemáticamente se expresa:
P = Σi pi , siendo P la presión total de la mezcla y pi la presión parcial de cada constituyente, es decir la presión que presentaría si solo ocupara el volumen de su recipiente.
Recuerda Σ significa sumatorio.
Esta ley se aplica a cualquier mezcla de gases, independientemente del número de gases que la componen.
A veces la puedes ver expresada de esta otra forma:
Representación Gráfica de la Ley de Dalton
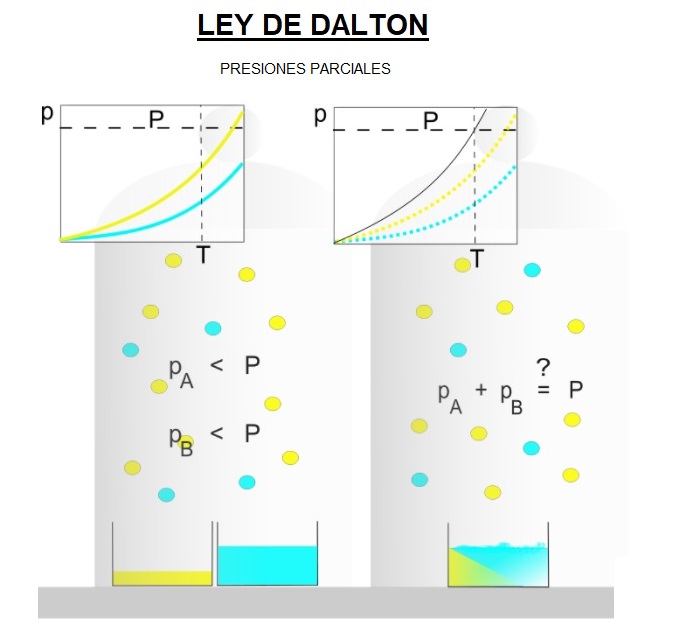
En la izquierda tenemos el gas amarillo dentro de un recipiente.
Vamos aumentando su temperatura y obtenemos la gráfica amarilla de presiones de ese gas dentro del recipiente para las diferentes temperaturas.
Ahora en ese mismo recipiente, vaciando el gas anterior, o en otro exactamente igual, metemos el gas azul y hacemos su curva de presiones para diferentes temperaturas, como hicimos con el anterior gas.
Por lo tanto lo que tenemos a la izquierda son las presiones que ejercen los gases A y B si estuvieran solos en el recipiente y sus gráficas (azul y amarilla)
Ahora tenemos a la derecha el recipiente con los gases mezclados.
Se puede observar que la presión total de la mezcla, curva negra, es igual a la suma de las presiones ejercidas por cada gas individualmente, suma de la curva azul y amarilla en cada punto.
Presión Parcial
Partiendo de la siguiente relación obtenida de la ecuación de los gases ideales, cuando V y T son iguales para la mezcla que para el gas 1 en particular:
P1/Pt = n1/nt
Donde P1 = Presión Gas 1
Pt = Presión Gas Total
n1 = Cantidad Gas 1 en moles
nt = Cantidad Gas total de la mezcla en moles
Si despejamos la presión parcial P! tenemos que:
P1 = Pt x (n1/nt)
Fórmula que se utiliza para calcular la presión parcial de un gas de una mezcla.
La presión parcial ejercida por un gas también se puede determinar multiplicando la presión total de la mezcla por la proporción molar que representa el gas en la mezcla.
OJO las presiones deben de ponerse en las mismas unidades y las cantidades en moles.
Para saber sobre los moles visitar: Mol y Número de Moles
También puedes verla expresada de la siguiente forma:
Proporción o Fracción Molar
A partir de la presión parcial de un determinado gas y la presión total de una determinada mezcla, se puede encontrar la fracción molar, llamada Xi, de un gas.
La fracción molar describe qué parte o fracción de una mezcla de gases es de un gas específico perteneciente a esa mezcla.
Por ejemplo, si el oxígeno ejerce 4 atm de presión en una mezcla y la presión total del sistema es 10 atm, la relación molar sería 4/10 o 0,4.
Xi = Pi /Pt
Pi = presión del gas que queremos calcular de la mezcla.
Pt = presión total
Podríamos llamarla el gas 1 P1, entonces la fracción molar sería la del gas 1, es decir X1 = P1/Pt
La fracción o proporción molar se puede aplicar a la presión, como en el ejemplo anterior, pero también a la cantidad de moles, como verás en la siguiente ecuación.
Por ejemplo en la relación anterior, que su relación molar sea 0,4 significa que 0,4 moles de la mezcla se componen de gas i.
La fórmula para la relación molar en moles sería:
Xi = ni /nt
Donde ni serían los moles de la sustancia del gas que queremos calcular su proporción, o llamarle n1
nt serían los moles totales de la mezcla o disolución.
Lógicamente esta Xi de una mezcla es igual que la Xi calculada con sus presiones.
Incluso podemos calcularla con el peso de la mezcla total y de la sustancia.
Por ejemplo si tenemos 100 gramos de una disolución de 50 gramos de sacarosa en 50 gramos de agua, la fracción molar de la sacarosa sería 0,5 (50/100).
La relación molar, ( XI ) se utiliza a menudo para determinar la composición de los gases en una mezcla.
La suma total de las fracciones molares de cada gas en una mezcla siempre debe ser igual a uno, ya que representan la proporción de cada gas en la mezcla.
La fórmula sería:
X1 + X2 + X3…….= 1
Ejercicios Ley de Dalton
Ejercicio 1):
Ejercicio 2)
Una habitación contiene 789 moles de nitrógeno, 210 moles de oxígeno y 1 moles de CO 2 . ¿Cuál es la presión parcial que ejerce el CO 2 ?
Ejercicio 3):
Si te ha gustado la Ley de Dalton web Pulsa Compartir. Gracias.
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.