Indice de Contenidos
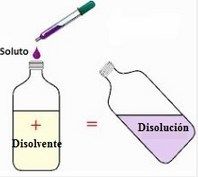
¿Qué es una Disolución?
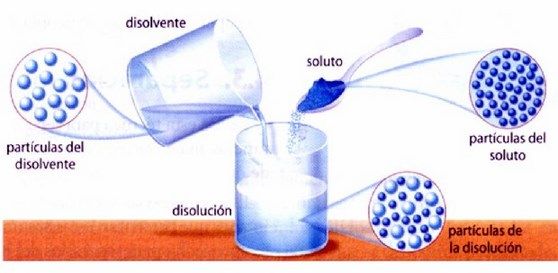
Una disolución es una mezcla homogénea, o lo que es lo mismo, una mezcla de 2 o más componentes que no reaccionan entre sí.
Que no reaccionan entre si significa que siguen siendo los mismos componentes después de mezclados.
Además por ser homogénea los componentes de la mezcla no se ven o diferencian después de mezclados a simple vista.
Un ejemplo: Sal en agua.
Pero entonces…
¿Qué diferencia hay entre una Mezcla Homogénea y una Disolución?
Pues bien cuando en la mezcla homogénea uno de los dos componentes es líquido, normalmente agua, esta mezcla homogénea es a lo que se le suele llamar disolución.
Las disoluciones químicas suelen estar en estado líquido.
Por ejemplo, el chocolate es una mezcla homogénea de varios componentes que no se diferencian a simple vista, pero están en estado sólido, por eso no se le llamaría disolución.
Si mezclamos agua con azúcar y revolvemos, al cabo de un tiempo no se verán los componentes en la mezcla, será una mezcla homogénea, pero ha esta si la podemos y debemos llamar disolución.
Puedes saber más sobre los tipos de mezclas en el siguiente enlace: Mezclas Homogéneas y Heterogéneas.
Componentes de una Disolución
Al componente más abundante en la disolución se le llama Disolvente y al resto se les llama Soluto.
A veces también se le llama a la disolución, solución, y al disolvente se le puede llamar solvente.
Como hemos dicho normalmente el disolvente es el líquido y la disolución está en estado líquido.
En el caso del agua con azúcar, el agua será el disolvente y el azúcar el soluto.
Conceptos Sobre Disoluciones
Si echamos azúcar en un vaso de agua llegará un momento que el agua ya no pueda absorber más azúcar.
Llega un momento que la disolución se satura, no admite más soluto.
Si seguimos echando más azúcar, ese azúcar en lugar de formar parte de la disolución irá al fondo del vaso.
En este caso diremos que la disolución es saturada.
En 100 gramos de agua la máxima cantidad de azúcar que podría disolverse sería lo que se conoce como la solubilidad de esa disolución.
– Solubilidad: en una disolución es la máxima cantidad de soluto expresada en gramos que se pueden disolver por cada 100 gramos de disolvente.
Tenemos que tener en cuenta que a mayor temperatura este el líquido (más caliente) más cantidad de soluto puede admitir, por lo que depende de la temperatura la cantidad para saturarlo.
Esto significa que si tengo agua a 20ºC y es capaz de absorber 10 gramos de azúcar, a 50ºC ese mismo agua es capaz de disolver más cantidad de azúcar.
Lo líquidos y los sólidos se disuelven mejor en otro líquido cuanto más caliente está este último.
El soluto es más soluble en líquidos calientes.
La solubilidad aumenta con la temperatura de la disolución.
– Concentración : es la cantidad de soluto que hay disuelto en una cantidad determinada de disolución.
OJO Cantidad de soluto/cantidad de disolución.
Nos da una relación de la cantidad de soluto que hay en la disolución.
c = cantidad de soluto/cantidad de disolución
Claro está que las cantidades se pueden expresar en gramos, en volúmenes, en moles, etc.
Por ejemplo un alcohol comercial que pone al 70% quiere decir que el 70% es alcohol y el 30% es agua.
Pero también podemos decir que el 70% del volumen de la botella es de alcohol y el 30% del su volumen es agua.
O que el 70% del peso es alcohol y el resto agua.
OJO a veces se puede hacer cantidad de soluto/cantidad de disolvente, en lugar de disolución, pero no es lo normal.
Normalmente a la fórmula anterior se le suele multiplica por 100 para que nos salga la concentración en porcentaje.
Veamos un ejemplo:
Tenemos 120 gramos de agua en la que echamos 20 gramos de azúcar.
¿Cuál es su concentración?.
Cantidad de soluto= 20 gramos
Cantidad de disolvente= 120 gramos
Cantidad de disolución = 20 + 120 = 140 gramos.
Aplicamos la fórmula:
c = 20/140 x 100 = 14, 28%
Quiere decir que el 14,28% es azúcar y el resto es agua.
Formas de Expresar la Concentración en Disoluciones
Cuando hablamos de la concentración de una disolución podemos expresarla de varias maneras, en función del disolvente, del soluto o de la disolución.
Aquí te dejamos un cuadro resumen:
Tipos de Disoluciones
Según su concentración las disoluciones pueden ser:
Diluidas: si la cantidad de soluto respecto del disolvente es pequeña.
Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del disolvente es grande.
Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto.
Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Fórmulas para Disoluciones
Lo primero decir dos pequeños trucos para resolver problemas.
– Al aplicar las fórmulas antes obtener las cantidades de soluto y de disolvente en las mismas unidades.
– Si en un problema de disoluciones ni me dan ni me preguntan una cantidad puedo suponer la cantidad que yo quiera.
Lo más utilizado es suponer 100gr de disolución o 1 litro de disolución.
Densidad = Masa / Volumen
Riqueza , pureza o % en masa % en masa = masa de soluto / masa disolución
Molaridad M = nº moles de soluto/litros de disolución
molalidad m = nº moles de soluto/Kg disolvente
fracción molar de soluto Xs = nº de moles de soluto/nº moles totales
fracción molar de disolvente Xd = nº de moles de disolvente/nº de moles totales
moles = Nº de moles = gramos/Mxm
gramos por litro g/l = gramos de soluto/litros de disolución
gramos de soluto + gramos de disolvente = gramos de disolución.
Aquí te dejamos un cuadro con las principales fórmulas:
Ejercicios Disoluciones
1) Calcular Molaridad (M) de una disolución obtenida disolviendo en agua 100 g de sulfato de cobre (II) y añadiendo después más agua hasta completar un volumen de un litro.
Datos que se dan : Masas Atómicas: S=32; Cu=63,5; O=16.
Solución:
El sulfato de cobre es CuSO4 (4 átomos de oxígeno tiene la molécula)
M = Moles de sulfato / Litros de Agua
Con los datos de las masas atómicas sacamos los moles por gramo del sulfato de cobre.
Cu + S + 4xO = 63,5 + 32 + 4x 16 = 159,5 gramos/mol. Según esto podemos calcular la cantidad de moles de sulfato que tenemos en 100gramos de sulfato, sabiendo que en 159,5 gramos hay un mol
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.





Podrías tener reglas que apliquen a tu formulario y que hagan que las personas pasen por alto estos campos obligatorios (o que los estés ocultando).
Si tu formulario tiene varias páginas, la persona puede haber salido de tu formulario antes de tiempo sin completar cada página.