¿Alguna vez has visto el hielo o un sólido cualquiera evaporarse directamente en gas sin pasar por el estado líquido?
Este proceso se llama sublimación y puedes enterarte de todo sobre este proceso en esta página.
Indice de Contenidos
¿Qué es la Sublimación?
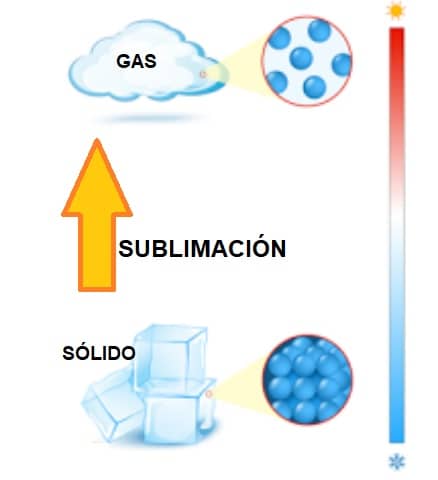
La sublimación es la conversión entre las fases sólida y gaseosa de la materia, sin pasar por una etapa líquida intermedia.
Las sustancias en las que se puede producir la sublimación se dice que son «Sublimes«.
Cloruro de amonio, bolas de naftalina, alcanfor son algunos ejemplos de sustancias sublimes. Luego veremos más.
La sublimación se usa con mayor frecuencia para describir el proceso de cambio de la nieve y el hielo en vapor de agua en el aire sin tener que derretirse primero en agua líquida o la del llamado «hielo seco«.
Resumiendo: Paso de Sólido a Gas Directamente, es decir, sin pasar por el estado líquido.
Luego veremos más detalladamente el hielo seco.
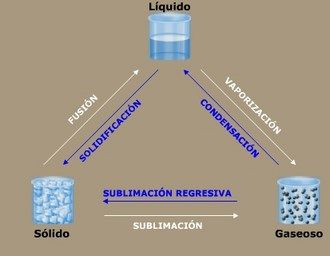
El proceso opuesto o contrario a la sublimación es la «Sublimación Regresiva«, donde el vapor de agua se convierte directamente en hielo, como copos de nieve y escarcha.
Tienes todos los cambios de estado de la materia en el siguiente enlace: Cambios de Estado.
¿Cómo es Proceso de la Sublimación?
Ocurre cuando las partículas de un sólido absorben suficiente energía para vencer por completo la fuerza de atracción entre ellas.
Los compuestos que son capaces de sublimar tienden a ser aquellos con fuerzas intermoleculares débiles en estado sólido.
Normalmente conseguimos subliminar la materia, la que lo permite, aumentando su temperatura.
Recuerda que cuando una sustancia se enfría, su energía interna disminuye y cuando se calienta, su energía interna aumenta.
Cuando se calienta al aumentar su energía interna el movimiento de sus partículas aumenta porque disminuyen las fuerzas de atracción entre ellas.
Partículas = átomos o moléculas que forman la materia (agua, aceite, etc)
En los sólidos esta fuerza de atracción es tan grande que el cuerpo es rígido, pero en estado gaseoso no hay prácticamente ninguna fuerza de atracción entre las partículas, por lo que se comportan con movimiento libre.
Para pasar de sólido a gas necesitamos dar calor para que las partículas de la materia en estado sólido venzan la fuerza de atracción que tienen en estado sólido y se conviertan en gas, sin fuerza de atracción entre ellas.
Se dice que la sublimación es una transición endotérmica, es decir que en el proceso se absorbe calor.
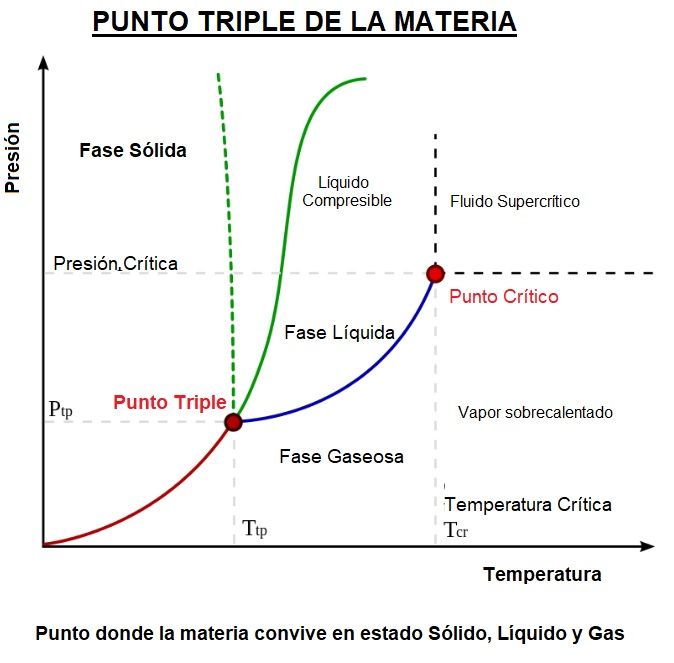
Se produce a temperaturas y presiones por debajo del punto triple de una sustancia (la temperatura y la presión a las que coexisten las tres fases) en su diagrama de fase.
Fíjate en el punto triple de la sustancia del diagrama de arriba.
A temperaturas y presiones inferiores a las del punto triple, puede producirse un cambio de fase entre las fases sólida y gaseosa.
A una temperatura dada, la mayoría de los compuestos y elementos químicos pueden poseer uno de los tres estados diferentes de la materia a diferentes presiones.
En estos casos, la transición del estado sólido al gaseoso requiere un estado líquido intermedio.
Pero a temperaturas por debajo de la del punto triple, una disminución de la presión resultará en una transición de fase directamente del sólido al gaseoso.
Además, a presiones por debajo de la presión de punto triple, un aumento de temperatura dará como resultado que un sólido se convierta en gas sin pasar por la región líquida.
Para algunas sustancias, como el carbono y el arsénico, la sublimación es mucho más fácil que la evaporación.
Esto se debe a que la presión de su punto triple es muy alta y es difícil obtenerlos como líquidos.
El sólido tiene presiones de vapor tan altas que el calentamiento conduce a una cantidad sustancial de vaporización directa incluso antes de que se alcance el punto de fusión.
El proceso de sublimación requiere energía adicional y, por lo tanto, es un cambio endotérmico.
La entalpía de sublimación (también llamada calor de sublimación) se puede calcular como la suma de la entalpía de fusión y la entalpía de vaporización.
La sublimación se puede realizar a presión atmosférica, pero a menudo se emplea presión reducida para mejorar la sublimación y acelerar el proceso.
Veamos un ejemplo de todo esto, El caso más famoso.
Sublimación del CO2
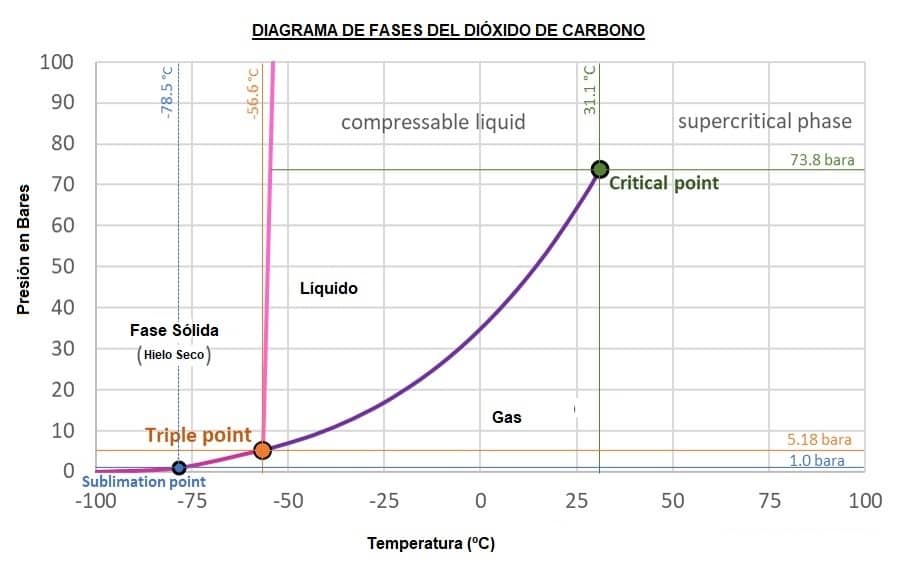
Veamos el diagrama de fases del Dióxido de Carbono.
A presión atmosférica (p = 1 bar, línea azul) y temperatura ambiente, unos 20ºC, el CO 2 se encuentra en estado gaseoso.
El «hielo seco» que es en realidad dióxido de carbono sólido y congelado, se sublima o se convierte en gas a una temperatura fría de -78,5°C cuando está a presión atmosférica (1Bar).
Si lo saco a la calle del congelador, como aumenta la temperatura a 20ºC, automáticamente empieza a subliminar.
La curva entre el punto triple hacia abajo y la presión cero muestra el punto de sublimación (Sublimation Point) con cambios de presión.
Otros materiales (por ejemplo, agua) tienen diagramas de fase que se parecen mucho a este.
Recuerda: Las partículas de una sustancia permanecen iguales cuando cambia de estado, solo cambia su proximidad, disposición o movimiento.
Esto significa que la naturaleza química de la sustancia en sí será la misma después del cambio de estado, al igual que la masa de la sustancia que también permanece igual.
Por ejemplo, 10 g de agua hierven para formar 10 g de vapor o se congelan para formar 10 g de hielo.
Ejemplos
No es fácil ver cómo ocurre la sublimación, al menos no con el hielo.
Una forma de ver los resultados de la sublimación es colgar una camisa mojada fuera en un día con temperaturas bajo cero.
Finalmente, el hielo de la camiseta desaparecerá.
Pero la mejor manera de ver el proceso de la sublimación no es usando agua, sino usar dióxido de carbono.
Mira esta imagen de hielo seco.
La niebla que ves es en realidad una mezcla de gas de dióxido de carbono frío y aire frío y húmedo, creado cuando el hielo seco sublima.
Además del hielo seco, las bolas de naftalina y ciertos ambientadores sólidos también pasan por el proceso de sublimación.
Los alimentos congelados son sublimes y encontrarás cristales de hielo dentro de la caja o bolsa donde se encuentran.
Los ambientadores sólidos son de naturaleza sublime.
Cuando las piezas de ambientadores sólidos se calientan en baño de agua caliente, podemos observar que los ambientadores sólidos se convierten directamente en gas a partir de sólidos.
Algunas impresoras especializadas utilizan el proceso de sublimación para imprimir imágenes de alta calidad.
Durante el proceso, el tinte pasa de sólido a gas y luego de nuevo a sólido sin pasar por la fase líquida.
De forma similar al hielo seco, las bolas de naftalina que ahuyentan las polillas son de naturaleza sublime. Las bolas de alcanfor también son sublimes.
La liofilización, proceso de deshidratación usado generalmente para conservar un alimento, también es un ejemplo de sublimación.
Cuando se transporta por encima de 615 ° C, el arsénico, tradicionalmente sólido, pierde su forma sólida y se convierte en un gas muy venenoso.
Bajo calentamiento de laboratorio, los cristales de yodo se transforman en un gas púrpura característico.
En determinadas aleaciones o mezclas homogéneas que normalmente se encuentran en forma de sólidos (compuestos con yodo, con azufre, etc.), la mezcla se puede purificar mediante sublimación, calentándola en condiciones controladas. Es un proceso similar a la destilación de líquidos: un sólido se sublimará y el otro permanecerá en el recipiente.
Creo que con estos ejemplos ya tienes bastante información sobre la Sublimación.
Si te gustá la página sobre la Sublimación pulsa en compartir. Muchas Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.

La sublimación es un proceso químico que provoca que un material solido se convierta en un material gaseoso sin pasar antes por el estado liquido causado por un cambio brusco en la temperatura.
La sublimación es el proceso que consiste en el cambio de estado sólido a estado gaseoso sin pasar por el estado líquido. Al proceso inverso, es decir, al paso directo del estado gaseoso al estado sólido, se le denomina sublimación inversa.