Indice de Contenidos
¿Qué es el Punto Triple?
En termodinámica, el punto triple de una sustancia es la combinación única de temperatura y presión a la que la fase sólida, la fase líquida y la fase gaseosa pueden coexistir en equilibrio termodinámico.
El término «punto triple» fue acuñado por James Thomson en 1873.
Por ejemplo, el punto triple de mercurio se produce a una temperatura de -38.83440°C y una presión de 0.2mPa, el del agua luego lo veremos explicado.
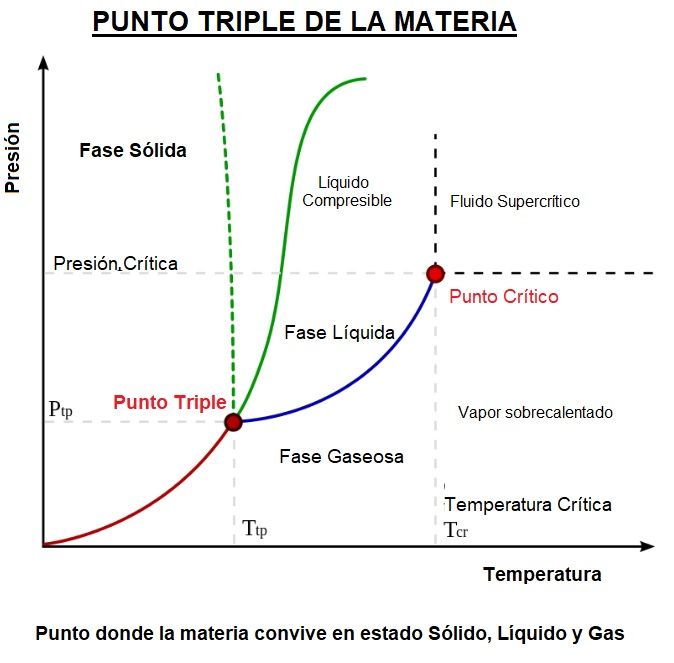
En la imagen vemos el diagrama de fase de una sustancia cualquiera y su punto triple.
Recuerda: Diagrama de Fases es el gráfico que muestra las condiciones limitantes para las fases sólida, líquida y gaseosa de una sustancia única cualquiera o de una mezcla de sustancias mientras se experimentan cambios de presión y temperatura.
En cualquier punto de las áreas separadas por las curvas, la presión y la temperatura permiten que solo exista una fase (sólida, líquida o gaseosa) o dos en los puntos (líneas) de cambios de fase.
«Solo en el Punto triple pueden coexistir las 3 fases»
A lo largo de la línea de sublimación, las fases sólida y de vapor o gaseosa están en equilibrio, a lo largo de la línea de fusión, las fases sólida y líquida están en equilibrio; y a lo largo de la línea de vaporización, las fases de líquido y vapor están en equilibrio.
El único punto en el que las tres fases pueden existir en equilibrio es el punto triple.
La temperatura del punto triple para cualquier sustancia pura esta muy próxima a la de fusión, puesto que la variación de esta última con la presión es muy pequeña.
El hecho es que el punto triple es una etapa que debe lograr para que comience la fase de sublimación.
La sublimación es la transición de una sustancia directamente desde la fase sólida a la fase gaseosa sin pasar por la fase líquida intermedia.
En la siguiente imagen animada puedes ver el punto triple del ciclohexano que ocurre a 6.33ºC y una presión de 5,388 kPa.
El Ciclohexano tiene la peculiaridad de poseer condiciones de punto triple que se pueden reproducir con facilidad y la podemos ver hirviendo, solidificando y derritiéndose con mínimos cambios de temperatura y presión.
Punto Triple del Agua
Por acuerdo internacional, al punto triple del agua se le ha asignado un valor en la temperatura de 0.01ºC (273.16 Kelvin o 32.02 °F) y una presión de vapor parcial de 611.66 pascales (6.1166 mbar; 0.0060366 atm).
En ese punto concreto, es posible cambiar toda la sustancia a vapor, agua o hielo mediante cambios arbitrariamente pequeños en la presión y la temperatura.
Es la combinación única de presión y temperatura a la que pueden coexistir agua pura, hielo puro y vapor de agua pura en un equilibrio estable.
En ese punto, es posible cambiar toda la sustancia a hielo, agua o vapor haciendo cambios infinitamente pequeños en la presión y/o la temperatura.
La temperatura del punto triple del agua, T3 =0.01ºC o 273.16 K, es la temperatura de punto fijo estándar para la calibración de los termómetros.
El diagrama de fase del agua es un diagrama de presión-temperatura para el agua que muestra cómo las tres fases (sólido, líquido y vapor) pueden coexistir juntas en equilibrio térmico.
A lo largo de la línea de vaporización, las fases de líquido y vapor están en equilibrio, a lo largo de la línea de fusión, las fases sólida y líquida están en equilibrio y a lo largo de la línea de sublimación, las fases sólida y de vapor están en equilibrio.
El único punto en el que las tres fases pueden existir en equilibrio es el punto triple.
El punto triple del agua corresponde a la presión mínima a la que puede existir agua en estado líquido.
A presiones por debajo del punto triple (como en el espacio exterior), el hielo sólido cuando se calienta a presión constante se convierte directamente en vapor de agua en un proceso conocido como sublimación.
En general, la sublimación es un cambio de fase de una sustancia directamente desde el sólido a la fase gaseosa sin pasar a través de la fase líquida intermedia.
Por encima del punto triple, el hielo sólido cuando se calienta a presión constante primero se derrite para formar agua líquida, y luego se evapora para formar vapor de agua.
Puede saber más sobre los cambios de estado en este enlace: Cambios de Estado.
También Te Puede Interesar:
–Niveles de Organización de la Materia
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.


¿Cómo puedo citar este artículo?
WebGrafia: http://www.areaciencias.com Gracias y un saludo