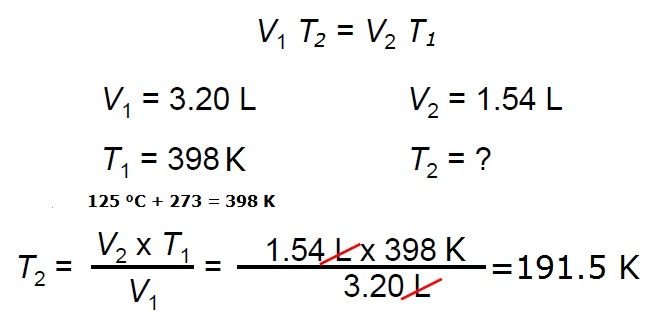Aquí tienes varios Ejercicios de Gases Resueltos.
Puede que antes te interese ver la teoría de los gases ideales en este enlace: Ley de los Gases Ideales.
Ejercicios:
1. Escribe falso o verdadero en cada enunciado. Justifica la respuesta:
a. (F ) Si la presión de un gas se duplica su volumen se reduce a la mitad, cuando la presión es constante.
Debería decir al final temperatura constante
b. (V) La presión que ejercen las moléculas de un gas sobre las paredes del recipiente depende del número de moles presentes.
Porque a más moles, más moléculas de gas y por ende más choques en las paredes del recipiente que las contiene.
La aseveración es también válida si disminuimos las moles, luego la presión disminuye.
Se puede afirmar que la P y el número de moles son directamente proporcionales.
c. (F ) El número de moléculas de un gas disminuye al decrecer la temperatura.
Porque es constante a cualquier condición( P y T).
No negar equivaldría a admitir que en invierno el número de integrantes del equipo favorito, es menor porque desaparecieron al disminuir la temperatura. Jaja.
d. (F ) Volúmenes iguales de hidrógeno y oxigeno contienen diferente número de moléculas, a las mismas condiciones de temperatura y prisión.
La hipótesis de Avogadro, para sementar la Química de los gases y no gases es suponer que a las mismas condiciones de T yP, volúmenes iguales de distintos gases hay el mismo número de moléculas en esos recipientes.
e. ( F) Al comprimir un gas la energía cinética de sus moléculas disminuye.
En gases ideales al aumentar la presión, para comprimir el gas la temperatura aumenta.
La ecuación de Bolztman describe que la energía cinética promedio del gas es igual a (3/2) la constante de Bolztman multiplicada por la temperatura.
Es decir E cinetica y T son directa,mente proporcionales.
f. (V ) El aumento de la temperatura de un gas ocasiona un mayor movimiento de las moléculas que lo conforman.
Es porque la energía cinética del gas aumenta segun la Ec. de Bolztman.
2. Justifica con qué Leyes de los gases explicarías cada uno de las siguientes situaciones:
a. La presión que existe en el interior de una olla de presión después de que comienza a funcionar la válvula de seguridad.
La válvula permite una P= constante, por lo tanto La Ley de Charles.
b. La variación de la presión y de la temperatura al trasladar un líquido dentro de un recipiente cerrado de Bogotá a Cartagena.
Proceso Isócoro(V= constante), Ley de Gay-Lussac.
c. En una habitación el aire caliente “sube”.
Incremento de la Energía cinética promedio, se aplica la c. de Bolztman.
d. En los globos aerostáticos, cuando la temperatura aumente, el helio se expande y ejerce una presión sobre las paredes internas del globo, logrando su elevación.
Se trata del incremento del volumen, al incrementar la Temperatura y la presión.
Se aplica la Ley general de los gases: P1.V1/T1=P2V2/T2.
3. Una muestra de gas presenta un volumen de 670 ml a 25°C.
¿Cuál es el volumen del gas si la temperatura asciende a 46°C?
Sabes que: 25°C= 298K y 46°C= 319 K.
Luego: Si la T aumente, entonces el V aumenta.
Nuevo V= 670 ml(319 / 298)= 717,21 ml. Rpta.
Se aplicado la Ley de Charles: V1/T1=V2/T2.
4. Una lata de fijador de cabello en aerosol contiene un gas con una presión de 1,25 atm, a 25°C.
La lata explota cuando la presión alcanza un valor de 2,50 atm. ¿A qué temperatura ocurrirá este fenómeno?
Para resolver este ejercicio utilizamos la fórmula de Gay-Lussac: P1T2 = P2T1.
Conocemos P1 (1,25 atm), T2 (25 °C = 298 K), P2(2,5 atm), por lo que solo nos queda hallar el valor de T2.
T2 = P2T1/P1 = (2,5 atm * 298 K)/1,25 atm = 596 K = 323 °C.
5. En un recipiente se tienen 35 litros de oxigeno a 20°C y una atmósfera de presión.
¿A qué presión es necesario someter el gas para que su volumen se reduzca a 10 litros, con la temperatura constante?
Para este ejercicio, asumiendo que el número de moles permanece constante, utilizamos la fórmula:
P1V1T2 = P2V2T1
T1 = T2 = 20 °C = 293 K (temperatura constante); V1=35 litros, P1 = 1 atm, V2 = (35-10) = 25 litros.
Necesitamos hallar P2
P2 = P1V1T2/V2T1 = (1 atm *35 L * 293 K)/(25 L * 293 K) = 1,4 atm
6. Una masa gaseosa ocupa un volumen de 5,6 litros a 18°C y 2 atm de presión. ¿Cuál es el volumen del gas si la temperatura aumenta a 38°C y la presión se incrementa a 2,8 atm?
Mismo planteamiento del ejercicio anterior (5).
7. Calcula el número de moles de un gas que se encuentra en un recipiente cerrado de 10 litros, sometido a una presión de 1,9 atm y 25°C.
Utilizamos la ecuación general de los gases: PV=nRT y despejamos el valor de n que es el que necesitamos hallar.
No olvides que debes convertir la temperatura a Kelvin y el valor de la constante R = 0,082 (atm*L)/mol*K)
8. Un globo se infla con 1,8 litros de aire a una temperatura de 290°K; si el globo se introduce dentro de un refrigerador a una temperatura de 270°K.
¿Cuál será el volumen del globo al sacarlo del refrigerador, si la presión permanece constante?
Utilizamos la ecuación de la ley de Charles: V1T2 = V2T1.
Necesitamos conocer el valor final de volumen V2; entonces V2 = (V1T2)/T1
9. Cierta cantidad de gas carbónico ocupa un volumen de 3,5 litros a 300°K y 1,5 atm de presión.
Si su volumen aumenta a 4,5 litros y la presión es de 2,2 atm.
¿A qué temperatura fue sometido el gas?
Mismo planteamiento del ejercicio 5.
10.
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.