Los elementos de la tabla periódica se clasifican en familias, también llamados «Grupos», porque las tres categorías principales de los elementos (metales, no metales y metaloides) son demasiado amplias.
En la tabla periódica de elementos, hay siete filas horizontales de elementos llamados «Períodos».
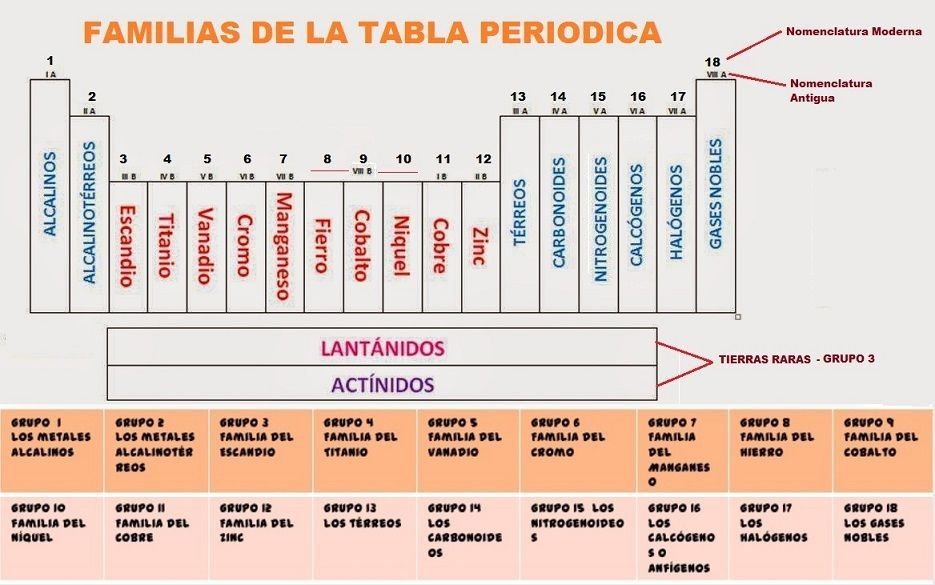
Las columnas verticales de elementos son lo que se denominan grupos o «Familias».
Puedes ver la división en la Tabla de mas abajo.
Indice de Contenidos
Familias de la Tabla Periódica
Los miembros de una misma familia o grupo en la tabla periódica (misma columna vertical) tienen propiedades similares.
Las familias están etiquetados en la parte superior de las columnas de una de estas dos maneras:
– El método más antiguo utiliza números romanos y letras (por ejemplo IIA). Muchos químicos todavía prefieren utilizar este método.
– El nuevo método utiliza los números del 1 al 18.
Cada familia reacciona de una manera diferente con el mundo exterior.
Los metales se comportan de manera diferente que los gases, e incluso hay diferentes tipos de metales.
Algunos elementos no reaccionan, mientras que otros son muy reactivos, y algunos son buenos conductores de la electricidad.
Todas las características de cada familia las veremos en otro punto más adelante.
Las 9 Familias Principales
– Metales Alcalinos – Grupo o Familia 1 (IA) – con 1 electrón de valencia.
– Los Metales Alcalinotérreos – Grupo o Familia 2 (IIA) – con 2 electrones de valencia.
– Metales de transición – Grupos o Familias del 3 al 12 – Pueden tener diferentes electrones de valencia, depende de su estado.
– Familia del de Boro o Térreos – Grupo o Familia 13 (IIIA) – Con 3 electrones de valencia.
– La Familia del Carbono o Carbonoides – Grupo o Familia 14 (IVA) – con 4 electrones de valencia.
– Familia del Nitrógeno o Nitrogenoides – Grupo o Familia 15 (VA) – con 5 electrones de valencia.
– La Familia del Oxígeno o Calcógenos – Grupo Familia 16 (VIA) – con 6 electrones de valencia.
– Halógenos – Grupo o Familia 17 (VIIA) – con 7 electrones de valencia.
– Los Gases Nobles – Grupo Familia 18 (VIIIa) – con 8 electrones de valencia.
Luego veremos de uno en uno y sus características, pero ahora vamos a verlos en la tabla periódica:
Aquí tienes el símbolo y los elementos de cada grupo:
¿Qué no sabes su nombre?
No hay problema.
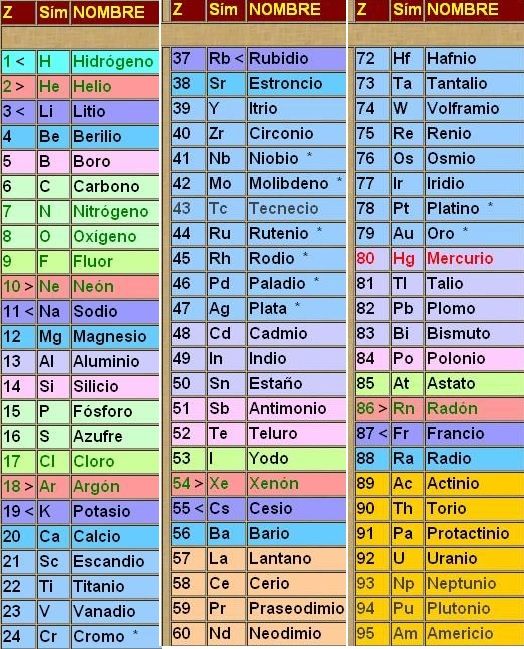
Nombres de los Elementos y Número Atómico
Aquí tienes todos los nombres de los elementos, y su número atómico (el numerito que hay en cada cuadrado arriba del símbolo) también llamado Z.
La familia IA tiene 1 electrón de valencia; la IIA tiene 2 electrones de valencia; la familia VIIA tiene 7 electrones de valencia; y la VIII A tiene 8 electrones de valencia.
Así que para las familias marcadas con un número romano y una A, el número romano da el número de electrones de valencia.
El número romano hace que sea muy fácil de determinar que el oxígeno (O) tiene seis electrones de valencia (que es en la familia VIA), que el silicio (Si) tiene cuatro, y así sucesivamente.
Como ves en la tabla de arriba de la columna 3 a la 12 las familias se nombran por el nombre del primer elemento de la columna y se llaman metales de transición.
Características de las Familias de la Tabla Periódica
Las características de los elementos de cada familia está determinada principalmente por el número de electrones en la capa externa de energía o última capa, también llamados electrones de valencia.
Estos son los electrones que van a reaccionar cuando el elemento se une con otro.
Si quieres saber más sobre estos electrones te recomendamos el siguiente enlace: Configuraciones Electrónicas.
Veamos las características concretas de cada familia.
La familia IA se compone de los metales alcalinos.
En las reacciones, estos elementos todos tienden a perder un solo electrón.
Esta familia contiene algunos elementos importantes, tales como el sodio (Na) y potasio (K).
Ambos de estos elementos juegan un papel importante en la química del cuerpo y se encuentran comúnmente en sales.
Se llaman así porque cuando reaccionan con el agua forman el álcali. No entra en este grupo el Hidrógeno.
La familia IIA se compone de los metales de tierras alcalinas.
Todos estos elementos tienden a perder dos electrones.
El calcio (Ca) es un miembro importante de la familia IIA (que necesita calcio para los huesos y dientes sanos).
La familia IIIA ninguno muestra tendencia a formar aniones simples.
Tienen estado de oxidación +3, pero también +1 en varios elementos.
El boro se diferencia del resto de los elementos del grupo porque es un metaloide, mientras que los demás van aumentando su carácter metálico conforme se desciende en el grupo.
Debido a esto, puede formar enlaces covalentes bien definidos, es un semiconductor, es duro a diferencia del resto que son muy blandos.
Tienen puntos de fusión muy bajos, a excepción del boro.
La familia IVA son los carbonoideos, no metales.
A medida que se desciende en el grupo, aumenta el carácter metálico de sus componentes.
el C y el Si son no metales, el germanio es un semimetal y el Sn junto con el Pb son netamente metálicos.
El C y el Si tienden a formar uniones covalentes para completar su octeto electrónico, mientras que el Sn y el Pb tienden a ceder, por su carácter metálico.
La familia VA son los no metales nitrogenoideos.
El N y el P son no metálicos, el arsénico y el antimonio son semimetales, a veces se comportan como metales y otras como no metales (esto es carácter anfótero).
El Bi es un metal. esta variación de no metálico a metálico, a medida que se avanza en el grupo, se debe al aumento del tamaño de los átomos.
Resulta más difícil separar un electrón del átomo de N que hacerlo con el de Bi, porque en el primero la atracción nuclear es más intensa.
Las moléculas de N son biatómicas, el P, As, Sb presentan moléculas tetratómicas en algunos de sus estados alotrópicos.
El Bi es biatómico. todos estos elementos forman enlaces covalentes.
La familia VIA son los no metales calcógenos.
Sus puntos de fusión, densidad y ebullición aumentan a medida que se desciende en el grupo, es decir a medida que aumenta el tamaño de los átomos.
Se combinan con el H para formar hidruros no metálicos.
De acuerdo a la electronegatividad, la afinidad química con el H decrece del O al Te. Cuando se combinan con el H, su número de oxidación de -2, pero cuando lo hacen con elementos más electronegativos presentan numero de oxidación positivo (4 , 6)
La familia VIIA se compone de los halógenos.
Todos ellos tienden a ganar un solo electrón en las reacciones.
Miembros importantes de la familia incluyen el cloro (Cl), que se utiliza en la fabricación de la sal de mesa y cloro, y el yodo (I).
La familia VIIIA se compone de los gases nobles.
Estos elementos son muy reactivos.
Durante mucho tiempo, los gases nobles fueron llamados los gases inertes, porque la gente pensaba que estos elementos no reaccionarían en absoluto con ningún otro elemento.
Un científico llamado Neil Bartlett mostró que al menos algunos de los gases inertes si puede reaccionar, pero requiere condiciones muy especiales.
Después del descubrimiento de Bartlett.
Metales, Lantánidos y Actínidos
Metales de Transición: El mayor grupo de elementos en la tabla periódica, que van de los Grupos del 3 al 12.
Tienen diferentes grados de reactividad y una muy amplia gama de propiedades.
En general, sin embargo, los metales de transición son buenos conductores del calor y la electricidad y tienen altos puntos de ebullición y densidades.
Lantánidos: son un grupo de metales situados en la segunda fila de la parte inferior de la tabla periódica.
Son bastante raros, sus números atómicos oscilan entre 57 (lantano) a 71 (lutecio).
Algunos de estos elementos se pueden encontrar en los superconductores, la producción de vidrio, o láser.
Actínidos: Son un grupo de metales en la última fila de la tabla periódica.
La familia de los actínidos contiene quince elementos que comienzan con el actinio.
Todos los actínidos son radiactivos y algunos no se encuentran en la naturaleza.
Video Familias Tabla Periódica
Para acabar te dejamos un vídeo que te puede interesar ya que habla de los grupos (familias) de la tabla periódica.
También Te te puede interesar:
Estructura de la Tabla Periódica
Historia de la Tabla de los Elementos
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.

Favor de poner los datos para hacer referencias de este articulo como el nombre del autor y fecha de publicación.
Autor Ernesto Rodríguez Arias. Profesor de Secundaria en España. La fecha es orientativa ya que el artículo se va actualizando, pero puedes poner año 2018. Sería bueno poner la webgrafia, que es el enlace o URL donde está el artículo.
Un saludo
fue de mucha ayuda realmnte
Excelente Aporte
fue un porte muy importante
fue muy importe leer este periódica
Muy interesante la información
muy interesantes estas informacion.
No sabia nada sobre el tema, me gusto mucho.
Muy buenas es muy interesante si le préstamo atención
Excelente
Excelente todo el contenido
Muy buenas y muy interesante
muy buena información
No tenía mucha información así Tan detallada sobre el tema me encanto maestro Gracias .
El material es muy bueno y nos informa sobre temas importantes
Información bastante completa, muy interesante, pero faltan los datos del autor para poder referenciar y dar el crédito correspondiente.