Antes de estudiar la estructura del átomo del carbono veamos un poco sobre el átomo de carbono.
Después veremos su estructura, los tipos de carbono, donde se encuentra el carbono y el ciclo del carbono.
Indice de Contenidos
Átomo de Carbono
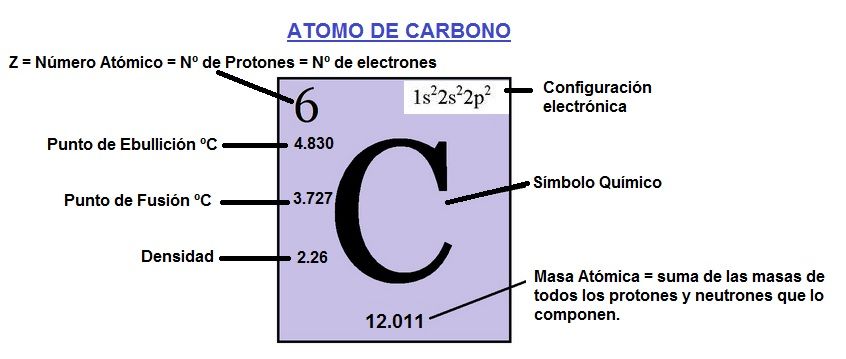
Dentro de la tabla periódica de los elementos lo encontramos como el elemento químico C situado dentro de los No metales con un número atómico de valor 6 y una masa atómica de 12.011.
Los átomos de carbono tienen 6 protones en el núcleo, 6 electrones que orbitan alrededor del núcleo y normalmente 6 neutrones.
Otras características del átomo de carbono son:
Punto de ebullición: 4.830ºC.
Punto de fusión: 3.727ºC.
Densidad: 2.267g/mL.
Estos datos más la configuración electrónica los puedes ver en la imagen de arriba. Algunos datos más sobre el átomo de carbono son:
Dureza escala de Mohs: 0,5
Valencia: 2,+4,-4
Estado de oxidación: +4
Electronegatividad: 2,5
Radio covalente (Å): 0,77
Radio iónico (Å): 0,15
Radio atómico (Å): 0,914
Estructura del Carbono
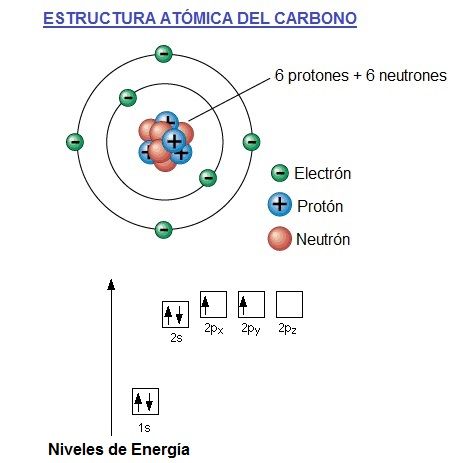
El átomo de carbono tiene 6 electrones, 4 de los electrones en su capa, órbita o banda de valencia (órbita más externa) y 2 en la capa más interna (más cercana al núcleo).
El dibujo de arriba es una simplificación del átomo de carbono y puede ser engañosa.
Da la impresión de que los electrones circulan en torno al núcleo en órbitas similares a la Tierra alrededor del sol.
En realidad, no es posible saber con exactitud dónde se encuentran los electrones. Además el átomo es una esfera (3 dimensiones).
Una manera mejor de mirar el átomo de carbono es mediante el uso de un gráfico de niveles de energía, también llamados orbitales de energía, que se muestra en la parte de abajo.
Vemos que el carbono tiene seis electrones representados uno por cada flecha.
Los cuadros representarían la órbita en la que están girando cada uno de ellos alrededor del núcleo.
Los electrones del cuadro de abajo (1s) son los que tienen menos energía, ya que son los que están girando más cerca del núcleo del átomo de carbono.
La dirección de la flecha representa el espín electrónico.
El espín es como la representación de la rotación del electrón sobre su eje, ya que no solo gira alrededor del núcleo, también lo hace sobre su propio eje como la tierra alrededor del sol, que gira alrededor de la tierra pero también sobre su propio eje.
Vamos a seguir explicando esto, pero antes fíjate en la siguiente imagen que representa mucho mejor el átomo de carbono:
Como ya deberíamos saber, sino lo sabes mira el siguiente enlace: Configuración Electrónica, los electrones del nivel de energía 1 están en el único subnivel de energía que tiene este nivel, que es el s, y que como admite como máximo 2 electrones, pues ahí estarán los 2 primeros, girando en ese órbita (representada por el cuadrado + arriba).
Los electrones del nivel 1 son los que tienen menos energía, ya que están mas cerca del núcleo.
Ahora pasamos al segundo nivel de energía, el nivel 2.
En el nivel 2, hay 2 subniveles de energía diferentes, el s y el p.
En el s, que solo admite 2, estarán los 2 electrones siguientes, y en el p, que admite hasta 6, con 3 orbitas diferentes, estarán los otros dos que faltan (recuerda que son 6 en total en el carbono).
Los electrones en el subnivel s del nivel 2, tendrán un poco menos de energía que los del subnivel p aunque los dos estén en el mismo nivel de energía, en el 2.
Los del p están girando un poco más separados del núcleo, por eso se representan un poco más arriba en la gráfica de niveles de energía.
Además si te fijas, los 2 electrones del subnivel p están girando cada uno en una órbita diferente y la otra órbita estará vacía.
Esto es así por que los electrones prefieren estar girando en órbitas diferentes, si pueden, aunque tengan el mismo nivel de energía.
Lógicamente si hubiera 4 electrones en el subnivel p, algunos tendrían que girar 2 en la misma órbita obligatoriamente, pero no es el caso del carbono.
Con la siguiente imagen seguro que te queda mucho más claro el nivel p:
Tipos de Carbono
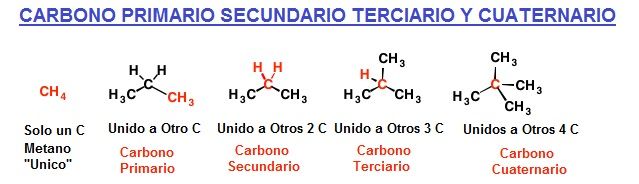
En química orgánica podemos clasificar los átomos de carbono como Carbono primario secundario terciario o cuaternario, en función del número de átomos de carbono adicionales unidos al átomo de carbono principal.
–Carbonos primarios: cuando un átomo de carbono está unido a otro de carbono. (Los hidrógenos, aunque por lo general suelen ser 3, se agrupan en esta tipo).
– Carbonos secundarios: están unidos a otros dos carbonos.
– Carbonos terciarios: están unidos a otros tres carbonos.
– Carbonos cuaternarios: están unidos a otros cuatro carbonos.
Si solo hay un átomo de carbono se llama «único».
Por otro lado, los isótopos son átomos que tienen el mismo número atómico pero diferentes números de masa.
Tienen el mismo número de protones pero diferente número de neutrones.
En el átomo de carbono puede variar dentro de unos pequeños límites.
Por ejemplo, hay tres tipos de átomo de carbono 12C, 13C y 14C. Todos ellos tienen el mismo número de protones, pero el número de neutrones varía.
–Carbono 12 = 6 protones, 6 neutrones y 12 aproximadamente de masa atómica.
– Carbono 13 = 6 protones, 7 neutrones y 13 aproximadamente de masa atómica.
– Carbono 13 = 6 protones, 8 neutrones y 14 aproximadamente de masa atómica.
Estos diferentes tipos de átomos de carbono se denominan isótopos del carbono.
El hecho de que tengan diferentes números de neutrones, no influye para las reacciones químicas del átomo de carbono.
El carbono también tiene alotropías.
Una alotropía es una propiedad química que poseen algunos materiales y que son alotrópicos cuando se pueden presentar en diferentes estructuras.
En el mismo estado físico pueden presentarse con dos o mas estructuras diferentes (el mismo elemento puede formar materiales diferentes).
Por ejemplo el carbono se puede presentar como diamante, como grafito y también, como no, como grafeno.
El grafeno ahora mismo está en proceso de investigación, y se supone que los resultados van a dar un material con enormes posibilidades.
¿Dónde se Encuentra el Carbono?
El carbono se encuentra en muchos compuestos diferentes: En los alimentos que comemos, en la ropa que usamos, en los cosméticos que utilizamos y en la gasolina que alimenta nuestros coches.
Estos son solo algunos ejemplos de donde está presente el carbono.
El carbono es el sexto elemento más abundante en el universo y el 15ª más común en la corteza terrestre.
Además, el carbono es un elemento muy especial, ya que juega un papel dominante en la química de la vida.
El carbono se encuentra en abundancia en el sol, las estrellas, los cometas y las atmósferas de la mayoría de los planetas.
En la atmósfera terrestre tenemos carbono en forma de dióxido de carbono.
El carbono se encuentra en combinación con otros elementos en los hidrocarburos (gas metano, petróleo y carbón.
En los minerales, tales como la piedra caliza, la dolomita, y el mármol, así como en ciertos depósitos marinos como conchas de ostras, también tenemos carbono en forma de carbonatos.
Por supuesto los diamantes también son carbono pero cristalizado
En las plantas, el dióxido de carbono del aire, junto con el agua, es absorbido por las plantas y se convierte en hidratos de carbono en el proceso de la fotosíntesis.
Los Animales consumen los hidratos de carbono, devolviendo el dióxido de carbono a la atmósfera por los procesos de respiración, excreción, la fermentación y descomposición bajo la acción bacteriana.
Pero a pesar de que se encuentra ampliamente distribuido en la naturaleza, principalmente está en combinación con otros elementos y sólo pequeñas cantidades se encuentran en estado libre o elemental.
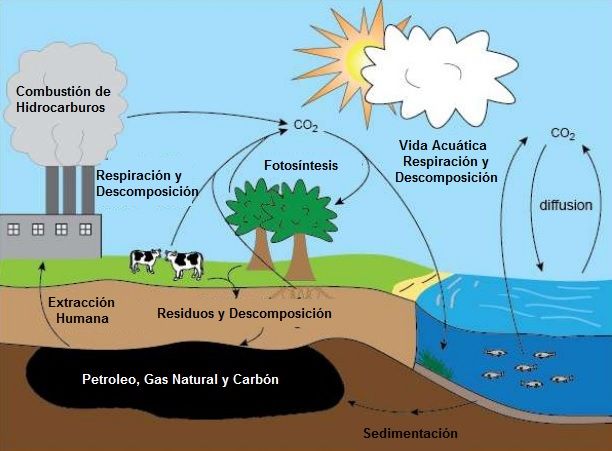
El carbono en la tierra sufre un proceso de conversión parecido al ciclo del agua, llamado Ciclo del Carbono.
Ciclo del Carbono
El ciclo del carbono es la circulación y transformación del carbono entre los seres vivos y el medio ambiente.
También te puede interesar:
Si te ha gustado la página sobre el Carbono pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.


Esta muy claro