La materia puede encontrarse en 3 estados principalmente: Sólido, Líquido y Gaseoso.
Puede tener un cuarto estado llamado estado de plasma, pero no es tan habitual como en los otros 3.
Si te interesa este cuarto estado pincha en el enlace anterior.
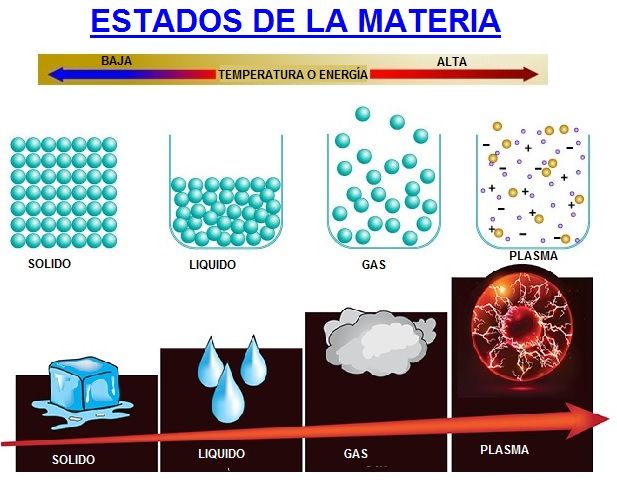
En la imagen de arriba puedes ver el estado molecular de la materia, es decir, cómo están las moléculas o átomos en cada uno de los estados y como puedes comprobar, es distinto para cada tipo de estado.
En esta página vamos a centrarnos y hablar sobre el Estado Gaseoso de la Materia.
Indice de Contenidos
¿Cómo es el Estado Gaseoso?
La materia en estado gaseoso se denomina “gas”. Pero…. ¿Cómo es la materia cuando se encuentra en este estado?
Cuando tenemos materia en estado gaseoso dentro de un recipiente, los átomos o moléculas (partículas) que lo forman no logran sujetarse unas a otras con firmeza y se mueven muy rápido con total libertad chocando entre sí.
Esto provoca que se difundan o se dispersen hasta que se distribuyen uniformemente ocupando todo el volumen del recipiente.
Por este motivo podemos decir que el gas es un estado de la materia que NO tiene una forma fija ni un volumen fijo.
Adoptan la forma del recipiente que los contiene y ocupan el volumen del recipiente por completo.
Además los gases tienen menor densidad que otros estados de la materia, como los sólidos y los líquidos, debido a que hay una gran cantidad de espacio vacío entre las partículas del gas, y además estas partículas tienen mucha energía cinética (movimiento) debido a su movimiento rápido dentro del recipiente.
Para ver las propiedades que tiene un gas, lo importante es el volumen del recipiente en el que está el gas, no de su forma.
La parte más baja de la atmósfera (llamada troposfera) en la que vivimos, es una mezcla de gases como Oxígeno, Nitrógeno, Dióxido de Carbono, Agua en Estado Gaseoso, etc.
En el siguiente enlace puedes ver los Gases del Aire.
El paso del estado gaseoso a líquido, se llama Condensación. Para saber más ir al enlace.
El paso de Líquido a Gas se llama Vaporización. Para saber más ir al enlace.
Características de los Gases
– No tienen forma ni volumen fijo.
– Tienen menos densidad que los otros estados de la materia.
– Sus partículas tienen mucha energía cinética (movimiento).
– Las propiedades de los gases dependen del volumen del recipiente que lo contiene, pero no de su forma.
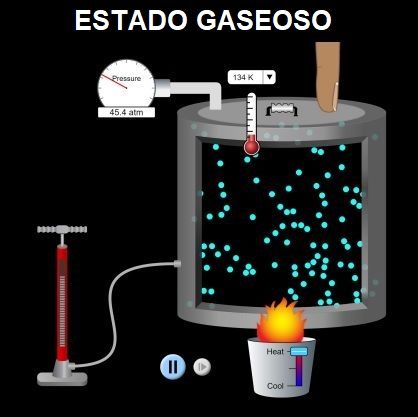
– Al aumentar la temperatura de un gas, las partículas se mueven más deprisa por lo que se aumentará la presióny tenderá a expandirse.
– Al bajar la temperatura de un gas las partículas se mueven más despacio por lo que disminuirá la presión, y el gas tenderá a comprimirse.
– El tamaño de las moléculas es insignificante en comparación con la distancia intermolecular media, es decir, sus átomos o moléculas están muy separadas.
– La fuerza intermolecular, entre las moléculas de elementos gaseosos, es despreciable.
Por lo tanto, estas fuerzas inexistentes entre las moléculas en el gas lo convierte en el estado más comprimible de la materia. De aquí obtenemos la siguiente propiedad de los gases.
– Los Gases son Altamente Compresibles, es decir se pueden comprimir mucho.
– Los gases se pueden mezclas uniformemente prácticamente sin necesidad de ayuda de ningún tipo.
La enorme distancia entre las moléculas da a las moléculas de otros elementos una gran facilidad para mezclarse unas con otras.
Esta propiedad de los gases los convierte en elementos químicos altamente reactivos (hacer reacciones químicas).
– Se difunden (se mueven y mezclan ocupando todo el espacio del recipiente) muy rápido en el vacío o entre otros gases.
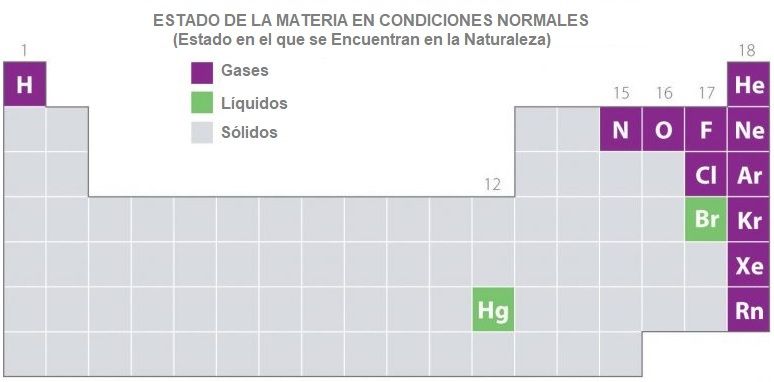
– Si observamos la tabla periódica, observamos que solo hay once elementos, que existen en estado gaseoso en condiciones normales de temperatura y presión (presión y temperatura ambiente), como se muestra a continuación:
De Donde Viene la Palabra Gas
La palabra “gas” fue acuñada por el científico de origen flamenco Jan Baptista van Helmont, en el siglo XVII.
Proviene del término latino chaos (“caos”), pues el estado observable de las partículas de un gas tiende a la dispersión y a un aparente desorden o caos.
En comparación con los sólidos y los líquidos, es el estado de la materia más caótico.
Cómo Medimos los Gases?
Cuando entran más partículas de un gas en un recipiente (añadimos gas), hay menos espacio para que las partículas se dispersen y se compriman, ejerciendo más fuerza sobre el volumen interior del recipiente.
Esta fuerza sobre el recipiente del gas se llama presión.
Hay varias unidades usadas para expresar la presión del gas. Algunas de los más comunes son atmósferas (atm), libras por pulgada cuadrada (psi), milímetros de mercurio (mmHg) y pascales (Pa).
Las unidades de presión se relacionan entre sí de esta manera:
1 atm = 14.7 psi = 760 mmHg = 101.3 kPa (1.000 pascales).
Además de la presión, indicada en las ecuaciones como P, los gases tienen otras propiedades medibles: temperatura (T), volumen (V) y número de partículas, que se expresa en un número de moles.
La temperatura se suele medir en grados Centígrados o Celsius (ºC), pero en el caso de los gases, muy a menudo se utilizaotra escala llamada grados Kelvin (ºK) e incluso otra llamada Fahrenheit (ºF).
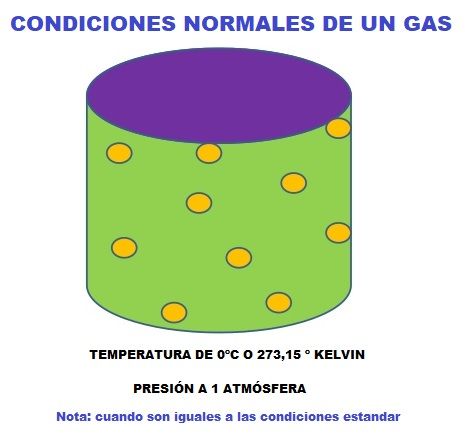
Debido a que la temperatura y la presión de un gas varían de un lugar a otro, para los cálculos y las ecuaciones, los científicos usan un punto de referencia estándar, llamado temperatura y presión estándar (STP o TPE en español).
La temperatura estándar es el punto de congelación del agua: 0 grados Celsius, 273.15 Kelvin o 32 grados Fahrenheit.
La presión estándar es una atmósfera (atm), que es la presión ejercida por la atmósfera en la Tierra a nivel del mar.
No confundir condiciones estándar (TPS) con condiciones normales de un gas (TPN).
Las estándar son las tomadas como punto de referencia y siempre son las mismas (0ºC y 1 atmósfera) y las normales son las que tiene el gas en el sitio o momento donde se realiza el experimento con el gas.
TPE = Temperatura y Presión Estándar
TPN = Temperatura y Presión Normales
Para saber más sobre esto visita: Condiciones Normales de un Gas.
Medir la Masa de un Gas
La masa de un gas se puede determinar fácilmente pesando el recipiente que contiene el gas y luego vaciando el recipiente sacando el gas y pesando nuevamente el recipiente vacío.
La diferencia entre las dos masas nos da la masa del gas. La cantidad de gas generalmente se expresa en términos de moles que se pueden obtener al dividir la masa del gas por su masa molar, es decir,
Moles = Masa / Masa molecular
Los moles se pueden convertir en el número de moléculas usando la relación 1 mol = 6.022 x 1023 moléculas
Para saber más visita: Mol.
Medir el Volumen de un Gas
A medida que un gas llena la totalidad del recipiente en el que se coloca, el volumen del gas es igual al volumen de su recipiente, que a su vez puede calcularse a partir de las dimensiones del recipiente.
La unidad de volumen en el Sistema Internacional (SI) es el metro cúbico (m3). Pero esta es una unidad demasiado grande.
Por lo tanto, las unidades comúnmente empleadas son el centímetro cúbico (cm3) o el decímetro cúbico (dm3).
Sin embargo, la unidad como mililitro (ml) y litros (L) también se utilizan, generalmente para expresar los volúmenes de líquidos y soluciones. Estas unidades se interrelacionan de la siguiente manera:
1m3 = 103 dm3 = 106 cm3
1 ml = 1 cm3
1 litro = 103 cm3 = 1dm3 = 10-3 m3
Te puede interesar ver: Instrumentos para medir Volumen.
Medir la Presión de un Gas
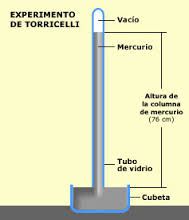
El instrumento utilizado para medir la presión atmosférica se llama barómetro.
Consiste en un tubo invertido lleno de mercurio en un plato de mercurio. La altura de la columna de mercurio sobre el nivel de mercurio en el plato es una medida de la presión atmosférica en ese lugar.
Para saber más: Barómetro.
Medir la Temperatura de un Gas
La temperatura es una medida del grado de calor o frialdad del cuerpo.
La medición de la temperatura se basa en el principio de que las sustancias se expanden al calentarse. La sustancia más común cuya expansión se utiliza en la medición de temperaturas es el «mercurio» (Hg).
La temperatura se mide con un termómetro, que si es de mercurio se llama «Termómetro de Mercurio«, aunque hoy en día hay termómetros de muchos tipos, incluso electrónicos mucho mejores que el de mercurio.
Recuerda que el mercurio es altamente contaminante si se derrama en la naturaleza.
Para saber más:Termómetro.
Relación entre Volumen, Presión y Temperatura de un Gas
En condiciones normales, tales como condiciones normales de presión y temperatura, la mayoría de los gases reales pueden ser tratados como gases ideales para hacer cálculos con ellos, dentro de una tolerancia razonable de error.
En esta condiciones tenemos varias leyes (fórmulas) que se pueden utilizar para relacionar las magnitudes de un gas y realizar cálculos y problemas de gases.
Este tema sería muy extenso de tratar aquí, por lo que te dejamos un enlace
Todas estas leyes las tienes explicadas en el siguiente enlace Leyes de los Gases Ideales.
¿Qué es el Vapor?
Es posible que escuche el término «vapor». Vapor y gas significan lo mismo.
La palabra vapor se usa para describir gases que generalmente son líquidos a temperatura ambiente y que se convierten en gas sin llegar a la temperatura de ebullición (temperatura crítica).
Por ejemplo el agua se convierte en vapor si la dejas al aire poco a poco, se evapora. Si la ponemos a 100ºC ebulle y también se convierte en gas, pero de forma mucho más rápida.
Buenos ejemplos de estos tipos de líquidos incluyen agua (H2O) y mercurio (Hg) que tienen el nombre de vapor cuando están en fase gaseosa.
Probablemente escuchará el término “vapor de agua” que significa agua en estado de gas.
Se suele llamar «vapor» al estado de equilibrio entre lo líquido y lo gaseoso.
¿Te ha gustado la web Estado Gaseoso?. Pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.